Titrasi Argentometri | Laporan Praktikum Kimia Analisis
ACARA
V
TITRASI
PENGENDAPAN: PENETAPAN KADAR NaCl
(TITRASI
ARGENTOMETRI)
A.
PELAKSANAAN PRAKTIKUM
1.
Tujuan Praktikum
a.
Membuat larutan AgNO3 0,1 N.
b.
Standarisasi larutan AgNO3 dengan
NaCl.
c.
Penetapan kadar klorida dalam sampel garam
dapur.
2.
Hari, Tanggal Praktikum
Rabu, 21 Desember
2016
3.
Tempat Praktikum
Lantai III, Laboratorium Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas Mataram.
B.
LANDASAN TEORI
Titrasi
pengendapan adalah golongan titrasi dimana hasil reaksi titrasinya merupakan endapan
atau garam yang sukar larut. Prinsip dasarnya adalah reaksi pengendapan yang
cepat mencapai kesetimbangan pada setiap penambahan titran; tidak ada pengotor
yang mengganggu dan diperlukan indicator untuk melihat titik akhir titrasi
(Khopkar,1990).
Argentometri yakni
titrasi yang menyangkut penggunaan larutan AgNO3. Argentometri
dimana terbentuk endapan (ada juga argentometri yang tergolong pembentukkan
kompleks) dibedakan menjadi tiga macam
berdasarkan indikator yang dipakai untuk penentuan titik akhir titrasi yaitu ;
pertama cara Mohr yaitu indikator yang digunakan adalah indikator K2CrO4,
titrannya AgNO3. Terutama untuk menentukkan garam klorida dengan
titrasi langsung atau mnentukkan garam perak dengan titrasi kembali setelah
ditambahkan larutan baku NaCl berlebih. Kedua yaitu cara Volhar, menggunakan
indikator Fe3+, titrannya KSCN atau NH4SCN untuk
menentukkan garam perak dengan titrasi langsung atau garam-garam klorida,
bromida, iodida, tiosianat, juga untuk anion-anion lain yang lebih mudah larut
dari AgSCN, tetapi dengan usaha khusus. PH harus cukup rendah sekitar 0,3 MH+,
agar Fe3+ tidak terhidrolisa. Dan yang ketiga adalah cara Fajans,
indikator yang digunakan adalah indikator adsorben menurut macam anion yang
diendapkan oleh Ag+, titran AgNO3 , pH tergantung dari
macam anion dan indikator yang dipakai (Harjadi, 1986).
Sturdi kuantitatif
mengenai reaksi penetralan asam-basa paling nyaman apabila dilakukan dengan
menggunakan prosedur yang disebut titrasi (titration). Dalam percobaan titrasi
suatu larutan yang konsentrasinya telah diketahui secara pasti disebut sebagai
larutan standar (standard solution) atau larutan baku, yang ditambahkan secara
bertahap ke larutan lain yang konsentrasinya tidak diketahui, sampai reaksi
kimia antara kedua larutan tersebut berlangsung sempurns. Jika kita mengetahui
volume larutan standar dan larutan tidak diketahui yang digunakan dalam
titrasi, maka kita dapat menghitung konsentrasi larutan yang tidak diketahui
itu (Chang, 2005).
Pembakuan larutan AgNO3 dengan NaCl,
dapat dilakukan dengan mengambil beberap mL larutan NaCl dengan konsentrasi
tertentu (atau N) menggunakan pipet volume, kemudian dimasukkan ke dalam
erlenmeyer. Tambahkan larutan K2CrO4, kemudian diaduk.
Titrasi dengan AgNO3 hingga terjadi perubahan warna menjadi merah
kecoklatan. Catat volume AgNO3 yang digunakan dan dhitung normalitas
larutan baku AgNO3 dengan rumus sebagai berikut :
Dimana V NaCl
adalah jumlah volume NaCl yang digunakan, N NaCl merupakan Normalitas dari NaCl,
dan V AgNO3 merupakan volume AgNO3 yang digunakan untuk
titrasi (Tilawati, dkk ; 2015).
Metode Mohr pada
titrasi argentometri (titrasi pengendapan) biasanya sering kali digunakan untuk
menentukkan kadar klorida dalam suatu sampel. Metode ini biasanya di cirikan
dengan adanya penggunaan indikator berupa K2CrO4 (Kalium
Kromat) (Bramha, dkk ; 2008).
itrasi argentometri dipakai untuk
menentukkan besarnya kadar garam pada sampel. Penggunaan argentometri dalam
penentuan kadar suatu zat dalam larutan dengan mengacu kepada titrasi
berdasarkan pembentukkan endapan dengan ion Ag+. Khusus dalam
penelitian ini, setelah larutan garam ditambahkan indikator kemudian dititrasi
dengan larutan AgNO3. Indikator yang pakai adalah K2CrO4
5 % (3 mL) yang ditunjukkan dengan adanya perubahan warna dari kuning jernih ke
merah keruh pada akhir titrasi. Hasil penelitian setelah dititrasi dengan AgNO3
, setelah NaCl habis, maka AgNO3 bereaksi dengan indikator K2CrO4.
Bentuk endapan yang dihasilkan dalam penelitian ini berwarna merah bata, dengan
reaksi 2Ag+(aq) + CrO42-(aq) Ag2CrO4 (aq)
(endapan merah bata) (Salosa, 2013).
C.
ALAT DAN BAHAN PRAKTIKUM
1.
Alat-Alat praktikum:
a.
Buret 50 mL
b.
Corong kaca
60 mm
c.
Erlenmeyer 250 mL
d.
Gelas arloji
e.
Gelas kimia 100 mL
f.
Gelas ukur 25 mL
g.
Labu ukur 100 mL
h.
Kertas label
i.
Pipet tetes
j.
Spatula
k.
Statif
l.
Timbangan analitik
m.
Tissu
2.
Bahan-Bahan:
a.
Aquades ( H2O(l) )
b.
Natrium klorida ( NaCl(s) )
c.
Kalium kromat
( K2CrO4(s)
)
d.
Perak nitrat
( AgNO3(s) )
D.
SKEMA KERJA


E.
HASIL PENGAMATAN
1.
Tabel perubahan fisik yang terjadi
|
No.
|
Perlakuan
|
Hasil
Pengamatan
|
|
a.
|
Pembuatan AgNO3
·
Ditimbang AgNO3 9,496 gr
·
Dilarutkan dalam 500 mL aquades
|
·
Warna AgNO3 : putih
·
Warna larutan : bening
|
|
b.
|
Standarisasi larutan
AgNO3
·
20 mL
larutan NaCl 0.01 N
·
+ 15
tetes ( 1 mL) indikator K2CrO4 5 %
·
Dititrasi dengan AgNO3
|
·
Warna
larutan : bening
·
Warna
larutan : bening
·
Warna
larutan : kuning susu dan ada endapan putih
|
|
c.
|
Penetapan kadar NaCl
dalam sampel
·
0,45
gram garam dapur
·
Dilarutkan hingga 100 mL
·
Diambil 25 mL larutan
·
+ 1 mL
indikator K2CrO4 5 %
·
Dititrasi dengan AgNO3
|
·
Warna
padatan : putih
·
Warna
larutan : bening
·
Warna
larutan : bening
·
Warna
larutan : kuning
·
Warna
larutan : kuning susu dan ada endapan putih
|
2.
Tabel volume titran yang digunakan
|
No.
|
Perlakuan
|
Volume titran
|
|
a.
|
Standarisasi larutan AgNO3
|
16,7 mL
|
|
b.
|
Penetapan kadar NaCl dalam
sampel
|
19,5 mL
|
F.
ANALISIS DATA

2.
Perhitungan

G.
PEMBAHASAN
Argentometri atau
titrasi pengendapan adalah penetapan kadar zat yang didasarkan atas reaksi
pembentukan endapan dari komponen zat uji dengan titran larutan titer perak
nitrat (AgNO3). Pada argentometri, ion perak memegang peranan
penting dalam pembentukan endapan. Cara ini dipakai untuk penetapan kadar ion
halida, anion yang dapat membentuk endapan garam perak, atau untuk pentapan
kadar perak tersebut.
Dalam praktikum kali ini memiliki tujuan sebagai
berikut: membuat larutan AgNO3 0,1 N, standarisasi larutan AgNO3
dengan NaCl, dan penetapan kadar NaCl dalam sampe garam dapur. Pada percobaan
pertama yaitu membuat larutan AgNO3 0,1 N. dimana 9,496 gram AgNO3.xH2O
ditimbang, kemudian dioven selama 2 jam. Proses pengovenan bertujuan untuk
memisahkan hidratnya yang terperangkat pada butiran/Kristal AgNO3.xH2O,
dimana air (hidratnya) dan pengotor yang terperangkap pada hidratnya menguap,
sehingga didapatkan AgNO3 yang murni. Namun percobaan pertama tidak
dilakukan pada praktikum kali ini.
Pada percobaan kedua yaitu, standarisasi larutan
AgNO3 dengan NaCl. Standarisasi
larutan AgNO3 bertujuan untuk mengetahui konsentrasi larutan AgNO3
agar dapat dijadikan larutan baku sekunder. Meskipun
pada percobaan pertama telah dilakukan pembuatan larutan AgNO3 0,1
N, namun supaya konsentrasi AgNO3 lebih tepat dan akurat sehingga
diperlukan standarisasi. Dalam hal ini, larutan AgNO3
distandarisasi dengan larutan standar primer NaCl 0,1 N. Kemudian untuk dapat mengetahui titik
akhir titrasi, digunakan larutan kalium kromat (K2CrO4)
encer. Indicator kalium kromat
digunakan karena beberapa hal diantaranya, dapat berlangsung pada suasana
netral, nilai Ksp (hasil kali kelarutan). Jika indicator kalium kromat
digunakan dalam suasana asam, maka ion CrO4, sebagian akan berubah
menjadi Cr2O72- menurut reaksi;
Dan jika pada suasana basa maka akan terbentuk endapan AgOH yang
selanjutnya teruari menjadi Ag2O sehingga titran terlalu banyak
terpakai. Menurut reaksi
Reaksi tersebutlah yang mengurangi konsentrasi indicator dan menyebabkan
tidak timbul endapannya atau sangat terlambat. Namun jika suasananya netral
antara (6 dan 10) pada saat titrasi akan terbentuk endapan putih AgCl dan
indikasi titik akhir tercapai terbentuknya endapan berwarna putih yang
berasal dari . Kemudian
ditinjau dari hasil kali kelarutannya, Ksp AgCl lebih rendah dibandingkan Ag2CrO4.
Dimana Ksp yang lebih rendah akan lebih mudah bereaksi dan membentuk endapan,
dimana pada praktikum ini terbentuk endapan putih AgCl, dan volume yang
dibutuhkan mencapai titik akhir titrasi adalah 16,7 ml, sehingga didapatkan normalitas AgNO3
sebesar 0,1198 N.
Pada percobaan ketiga,
prinsipnya sama dengan pada percobaan kedua. Namun, pada percobaan ketiga ini
larutan AgNO3 yang telah distandarisasi digunakan untuk menentukan
kadar NaCl dari sampel garam dapur. Berdasarkan hasil percobaan volume titrasi yang digunakan adalah
19,5 ml, hal yang sama
juga terjadi antara percobaan kedua dan ketiga. Kemudian kadar NaCl
dalam sampel 0,45 gram sebanyak
136,66185 mg dan dengan
persentase sebesar 30,3693 %.
H.
KESIMPULAN
Berdasarkan hasil percobaan yang telah dilakukan, maka dapat kesimpulan bahwa:
1.
Untuk membuat larutan AgNO3 0,1 N
dapat dilakukan dengan mengoven
AgNO3.xH2O
selama 2 jam untuk
memurnikan AgNO3 dari pengotor-pengotornya kemudian
dilarutkan dalam aquades.
2.
Pada
standarisasi AgNO3
digunakan indicator K2CrO4
, karena lebih dan untuk mengetahui titik akhir titrasi yang ditandai terbentuknya endapan
putih yang berasal dari AgCl dan
indicator K2CrO4 juga bereaksi pada suasana netral. Sehingga
didapatkan normalitas AgNO3
sebesar 0,1198 N.
3.
Penentuan
kadar NaCl dalam garam dapur dilakukan dengan cara titrasi argentometri dimana diperoleh kadarnya 136,66185
mg dan 30,3693 %.
DAFTAR PUSTAKA
Brahmana, Satyanarayan, dkk. 2008. Spatial Variation in
Hydrologycal Characteristics of
Chilika – A Coastal Lagoon of Indi. India : Depatment of Marine Sciences,
Berhampur University.
Chang, Raymond. 2005. Kimia Dasar Konsep-Konsep Inti Edisi
Ketiga Jilid 1. Jakarta : Erlangga.
Harjadi, W. 1986. Ilmu Kimia Analitik Dasar. Jakarta :
Gramedia.
Khopkar, S. M. 1990. Konsep Dasar Kimia Analitik. Jakarta :
Universitas Indonesia Press.
Salosa, Yenni Y. 2013. Uji Kadar Formalin, Kadar Garam dan
Total Bakteri Ikan Asin Tenggiri Asal Kabupaten Sarmi Provinsi Papua. Papua :
Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Universitas Negeri Papua.
Tilawati, Wahyu, dkk. 2015. Identifikasi dan Penetapan Kadar
Klorin (Cl2) dalam Beras Putih di Pasar Tradisional Klepu dengan
Metode Argentometri. Klaten : Prodi D III Farmasi, STIKES Muhammadiyah Klaten.
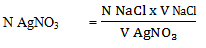



Comments
Post a Comment